Las propiedades básicas de la energía, son la descripción de las leyes de la termodinámica el cual hacen parte de una magnitud (cantidad total), y la calidad (utilidad) de la energía.
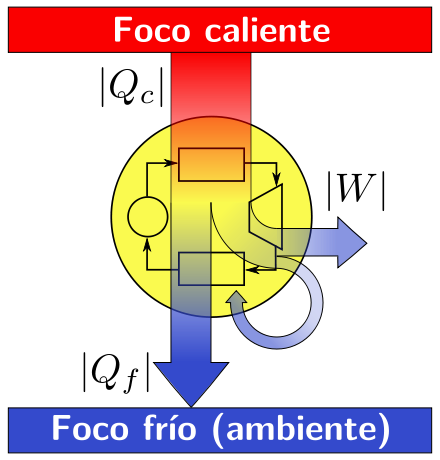
- La Primera Ley de la Termodinámica: Determina, que la energía no se puede crear ni se destruye mediante proceso ordinarios (a parte de las reacciones nucleares). No obstante, la energía tiene la facultad de cambiar de forma, es decir, de energía química a energía térmica o de movimiento. Si en un sistema cerrado, donde no permitan el ingreso ni salida de energía o materia, y si se puede medir la energía en todas sus formas tanto antes como después de que ocurra un proceso específico, se encontraría que la energía total antes y después del proceso especifico, se encontraría que la energía total antes y después del proceso se mantiene sin cambio. Por tanto, la primera ley también se le conoce como la “la ley de la conservación de la energía”.
De acuerdo con lo anterior, trayendo un ejemplo, un automóvil, antes de encenderse el motor, toda la energía del auto es energía potencial la cual se encuentra acumulada en los enlaces químicos de la gasolina. Cuando el auto se encuentra en movimiento, alrededor del 25% de esta energía potencial se convierte en energía cinética de movimiento. Sin embargo, de acuerdo con la primera ley, la energía no se crea ni se destruye. Entonces ¿qué pasa con la energía perdida durante este proceso? La gasolina quemada no solo mueve el auto, sino a su vez calienta el motor, el sistema de escape y el aire que rodea al auto. La fricción de las llantas sobre el asfalto calienta ligeramente este último. De manera que, la energía no se pierde. La cantidad de energía potencial química no cambia, aunque su forma lo haya hecho. Así mismo, un atleta está transformando la energía potencial química almacenada en las moléculas de los alimentos ingeridos, en la misma cantidad total de energía cinética de movimiento.
- La Segunda Ley de la Termodinámica: Determina que, cuando la energía se convierte de una forma a otra, disminuye la cantidad de energía útil. Es decir, la segunda ley dice que todas las reacciones o cambios físicos transforma la energía de formas más útiles a formas menos útiles. Trayendo el caso del auto, el 75% de la energía acumulada en la gasolina que no fue consumida al mover al auto fue convertida en energía térmica. El calor es una forma de energía menos útil ya que tan solo incrementa el movimiento aleatorio de las moléculas en el auto, la vía y el aire.
De la misma forma, la energía térmica empleada en los atletas al liberarla en el aire cuando es procesada al quemar los alimentos digeridos para producir energía, no se aprovecha para correr de una más veloz ni de larga distancia. Además, la segunda ley indica que ninguno de los procesos de conversión de la energía, ni siquiera los que se efectúan en el cuerpo, es 100% eficiente en el empleo de la energía para la obtención de un resultado en particular.
Esta segunda ley de termodinámica a su vez habla acerca de la organización de la energía. La energía útil por lo general es acumulada de manera muy ordenada, y siempre que la energía es usada dentro de un sistema cerrado, existe un incremento general en la aleatoriedad y en el desorden de la materia. Por ejemplo, una casa; sin un esfuerzo significativo en el que demanden una energía, la acumulación de los platos sucios, los libros, los diarios, y la ropa se amontonan desordenadamente en el piso, al igual que las sabanas en la cama.
Para la energía química los ocho átomos de carbono de una sola molécula de gasolina poseen una ordenación más regular, que los átomos de carbono que se mueven aleatoriamente y las nueve moléculas de agua que se forman al quemarse la gasolina. Lo mismo sucede con las moléculas de glucógeno acumuladas en los músculos de un atleta, estas sin convertidas en cadenas de moléculas de azúcar altamente organizadas en dióxido de carbono y aguas más simples cuando son utilizadas por los músculos. Esta disposición hacia una pérdida de complejidad, en orden y energía útil, así como hacia un aumento en la aleatoriedad, el desorden y la energía menos útil, es conocida como “entropía”. Para ser contrarrestada ésta se requiere que la energía ingrese a un sistema desde una fuente externa.
Para la vida en este planeta la segunda ley de la termodinámica, ¿Cómo es posible la vida? Si todas las reacciones químicas, incluso las que se efectúan al interior de las células vivas, hacen que aumente la cantidad de energía inutilizable, y si la materia tiende hacia mayor aleatoriedad y desorden. ¿Cómo pueden acumular la energía inutilizable y las moléculas tan ordenadas que caracterizan a los seres vivos?
Como respuesta a estas preguntas, son las reacciones nucleares que se efectúan en el Sol producen energía en forma de luz solar, este proceso a su vez ocasiona enormes incrementos en la entropía como calor. En la Tierra los seres vivos utilizan un suministro continuo de energía solar para sintetizar las moléculas complejas y mantener estructuras ordenadas: para “luchar contra el desorden”. Los sistemas altamente organizados, bajos en entropía, que caracterizan la vida, no violan la segunda ley de la termodinámica, ya que se logran por medio de un flujo continuo de energía utilizable del Sol.










Arturito - septiembre 6, 2018 @ 19:14
Claro y conciso.