¿Qué es un orbital atómico?
Un orbital atómico es la región que comprende el comportamiento ondulatorio de uno o un par de electrones dentro de un átomo y alrededor del núcleo del mismo. Así, gracias a los orbitales puede calcularse la probabilidad que se tiene de encontrar un electrón en una región específica de un átomo. Cada orbital está determinado por tres valor cuánticos, n, ℓ , y m, que corresponden a la energía del electrón, el momento angular orbital y el vector de dicho momento. La suma de todos los orbitales da lugar a la corteza electrónica de cada átomo, que usualmente se representa en un modelo de capas.
Como se menciona anteriormente, los orbitales no determinan la posición de un electrón sino la probabilidad de encontrarlo en dicha región. La idea de los orbitales fue introducida tras la aplicación de la mecánica cuántica a los modelos atómicos. Así, los orbitales son las funciones de onda monoeléctricas que representan los estados espaciales y estacionarios de los átomos hidrogenoides. Es por eso que en los átomos de hidrógeno la ecuación de Schrödinger tiene una aplicación exacta. A pesar de que los cálculos resultan más complejos e inexactos en otro tipo de átomos (propios de la estadística de Fermi), los orbitales han sido de gran utilidad para el estudio de sistemas polielectrónicos y polinucleares, para cuyo caso se aplican los orbitales moleculares.
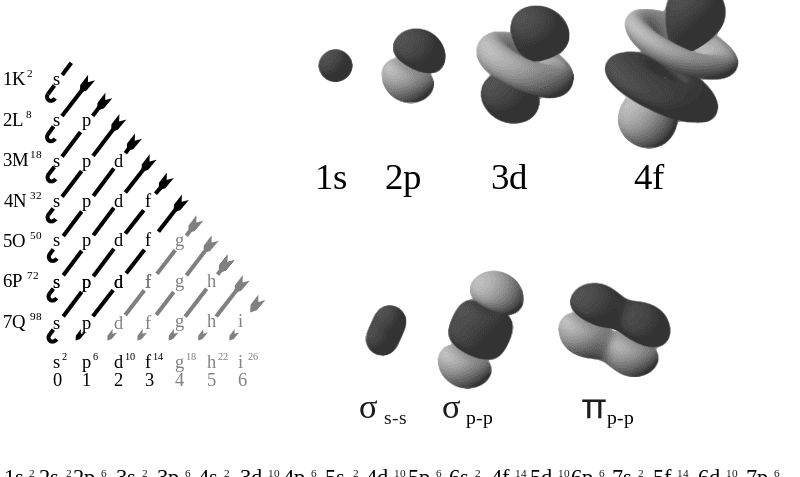
Los orbitales se organizan de la siguiente manera a través de siete niveles según la regla de Madelung y el Principio de Aufbau: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6. Esto puede expresarse mejor de la siguiente manera:

¿Cuáles son las formas de los orbitales?
Las formas, en la parte angulas, de los orbitales (sin tener en cuenta los nodos radiales que son siempre esféricos) son:
- Orbital s: este tiene una forma esférica alrededor del núcleo atómico. De esta manera, se conforma una especie de nube que determina la probabilidad de encontrar un electrón, siendo más densa cuanto más cerca está del núcleo y más dispersa cuanto más se aleja.
- Orbitales p: estos tienen forma de dos esferas que se achatan en el lugar donde entran en contacto (núcleo atómico), cuya orientación varía según los ejes de las coordenadas.
Así, se obtienen tres orbitales simétricos (orbital px, orbital py y orbital pz) dependiendo del valor del número cuántico ml, que puede ser -1, 0 ó 1. Al igual que en caso anterior, la probabilidad de encontrar un electrón es mayor si la posición está más cerca del núcleo. - Orbitales d: estos tienen diversas orientaciones y formas. De los cinco orbitales d, cuatro de ellos tienen la apariencia de 4 lóbulos cuya parte más angosta está cerca del núcleo y cuya parte más ancha está más alejada del centro; el otro orbital d tiene forma de dos lóbulos rodeados en su interconexión por una dona nodal. Todas estas formas tienen n-3 nodos radiales.
- Orbitales f: estos tienen formas aún más complejas, que pueden describirse como las formas de los orbitales d más un plano nodal. Así, se tienen siete formas nodales con n-4 nodos radiales.