¿Qué es el modelo atómico de Bohr?
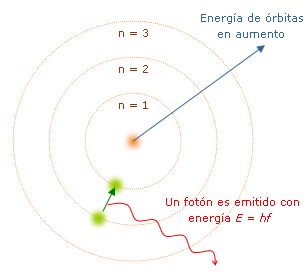
El modelo atómico de Bohr fue el primer modelo atómico en el que se introdujo la cuantización. De esta forma, fue un modelo que aunó la física clásica con la física cuántica. Este fue propuesto por el físico danés Niels Bohr en 1913, y se diferencia de los demás porque propone que los electrones orbitan alrededor del núcleo del átomo. Este modelo prosiguió al de Rutherford e incorporó ideas del llamado efecto fotoeléctrico, propuesto por Albert Einstein, y de los estudios de Max Planck. Según Niels Bohr, los electrones podían ocupar distintas órbitas alrededor del núcleo y cada una de ellas poseía distintos niveles energéticos, expresadas por el número n (el número cuántico principal). Así, las más cercanas al núcleo atómico eran las más energéticas; y si un electrón pasaba de estas a una órbita de menor nivel energético, liberaba un fotón en el proceso.
¿Cuáles son los postulados de Bohr?
Niel Bohr desarrolló su modelo atómico a partir de los siguientes tres postulados:
Primer postulado: los electrones realizan órbitas circulares alrededor del núcleo del átomo sin irradiar energía.
Segundo postulado: alrededor del núcleo atómico sólo hay órbitas para los electrones cuyo momento angular sea un múltiplo entero de ![]()
Tercer postulado: los electrones sólo pueden emitir o absorber energía al saltar de una órbita a otra. En estos casos, el electrón absorbe o libera un fotón cuya energía es igual a la diferencia de energía entre los dos niveles.